상세 컨텐츠
본문

1. 아보가드로수와 몰
- 질량수가 12인 탄소의 질량을 12라고 했을 때, 그 속에 포함된 탄소 입자의 개수는 6.02×1023개이다.
- 아보가드로수 : 6.02×10^23개
- 몰(mole) : 입자를 아보가드로수로 묶는 개념, 단위로 사용할 때는 ‘몰(mol)’이라 한다.
- 1몰(mol) = 6.02×10^23개, 2몰(mol) = 2×6.02×10^23개, 3몰(mol) = 3×6.02×10^23개
- 물 분자(H2O) 1몰 속에는 수소 원자(H) 2몰과 산소 원자(O) 1몰이 들어있다.


2. 질량과 몰
- 원자량과 분자량은 상대적인 값으로서 단위가 없기 때문에, g을 붙이면 그램원자량 및 그램분자량이라 한다.
- 원자 1몰의 질량은 그램원자량값이고, 분자 1몰의 질량은 그램분자량값이다.
- 산소 원자(O) 1몰의 질량 = 산소 원자의 그램원자량 = 16g
- 물 분자(H2O) 1몰의 질량 = 물 분자의 그램분자량 = (수소 원자의 그램원자량)×2 + 산소 원자의 그램원자량 = 18g
- 몰의 질량이 화학식량에 g을 붙인 값이라면, 총 질량을 화학식량으로 나누어서 몰수를 구할 수 있다.

3. 부피와 몰
- 아보가드로 법칙 : 같은 온도, 같은 압력, 같은 부피 속에서 모든 기체는 종류에 상관없이 분자수가 같다.
- 기체 분자가 차지하는 전체부피에 비해 기체입자의 크기가 매우 작기 때문에, 기체는 입자의 크기가 아닌 입자의 개수가 부피에 영향을 준다.
- STP조건(0℃, 1기압 상태)에서는 기체 1몰의 부피는 22.4L 이다.

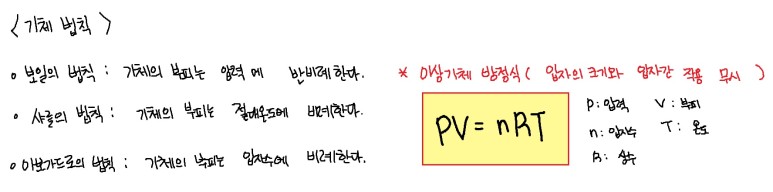
4. 밀도와 몰

5. 이상 기체 방정식

'[Study] 지식 한 스푼' 카테고리의 다른 글
| [고등화학] 연소 분석법(리비히 분석법) (0) | 2020.03.10 |
|---|---|
| [고등화학] 원소 분석 방법의 종류 (0) | 2020.03.10 |
| 노트북 충전이 안될 때 원인과 해결방법 (0) | 2020.03.08 |
| 무엇이 맞는 표현일까? (위안부 할머니, 종군 위안부, 근로정신대) (0) | 2020.03.08 |
| 차훈득기 시연과정: "ChahunMeditation" process (0) | 2020.03.08 |